单细胞测序技术用于心脏再生医学
心脏是哺乳动物发育阶段最先形成的器官,为全身生命活动提供血液支持。虽然心脏功能如此关键,但成熟的心肌细胞一般不具有增殖能力,导致心脏损伤不可逆转,因此全世界范围内很多科学家都在探索如何使心脏恢复再生能力[1][2]。
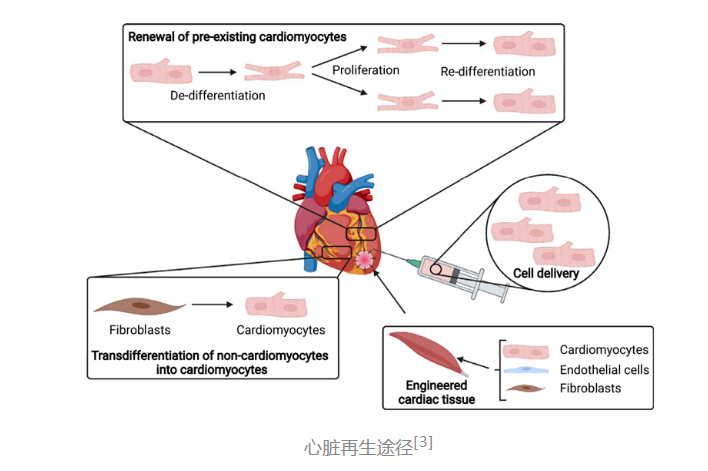
目前,在心脏再生能力的研究方面,大家最为关注的是:如何让成熟的心肌细胞再次进行细胞增殖。因为心肌细胞可以自发跳动,所以,如果能有新增殖的心肌细胞代替受损的细胞,那么就很有可能实现心脏功能的修复。
为了寻找让心肌细胞增殖的方法,近日,来自北京大学未来技术学院的熊敬维研究组在国际知名期刊《Cell Stem Cell》上在线发表了一项题为“A small-molecule cocktail promotes mammalian cardiomyocyte proliferation and heart regeneration”的单细胞测序研究。在这项研究里,作者发现了由几个小分子组成的混合物,能使成体的心肌细胞实现增殖 ,进而促进心脏修复。

研究思路
通过体外-体内-体外的流程来进行筛选和测试:
1. 首先通过体外的大规模筛选,找到备选的生物活性物质;
2. 再对这些具有生物活性的小分子进行动物体内的实验测试;
3. 最后将被激活的细胞在体外的环境下进行培养和单细胞测序分析。
文章主要研究内容总结如下:
1. 药物小分子组合可以刺激心肌细胞繁殖
为了找到让心肌细胞增殖的方法,研究人员首先对成千上万种药物小分子进行了筛选,希望能从中找到刺激心肌细胞增殖的药物。 为了筛选出好用的药物,作者利用了两种不同的系统来对药物小分子进行筛选:
一种是FUCCI系统,用来对备选药物进行初筛,看药物是否能让心肌细胞“焕发青春”——“青春”了才有可能恢复增殖能力。
另一种是MADM系统,用来对这些FUCCI系统筛选出来的备选药物进行复筛,看哪些药物能够让心肌细胞恢复“传宗接代”的能力。
通过这两个筛选系统,作者筛选出了13种小分子,并经过简单的实验证明,这些小分子是可以促进心肌细胞的增殖的。接下来,作者将这13个备选分子进行了随机的两两组合,并且借助计算机的算法,最后确定了10组效果可能比较好的小分子的组合。
为了验证这些组合的效果,作者又进一步对上面这10种组合做了FUCCI和MADM筛查。最后发现,有5个小分子(合称5SM)可以明显地促进成体小鼠和大鼠心肌细胞的分裂和心脏再生。并且,一系列的病理学实验也证明,5SM可以促进心肌梗死心脏的心肌细胞增殖。
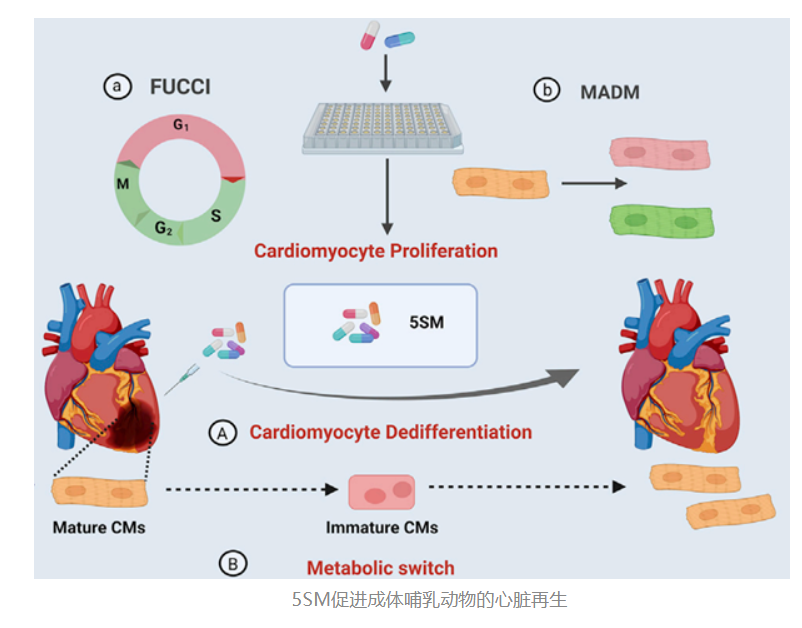
2. 药物小分子组合可以重新激活心脏功能
为了进一步研究5SM是如何促进心肌细胞增殖,作者首先进行了RNA-seq和ATAC-seq,发现5SM可以促使成熟的心肌细胞进行去分化,重新变为非成熟的心肌细胞,真正“返老还童”,从而获得再次分裂增殖的能力。
在这个过程中,有很多与糖酵解和去分化相关的基因被激活并活跃表达,为心肌细胞的“返老还童”作出了贡献。
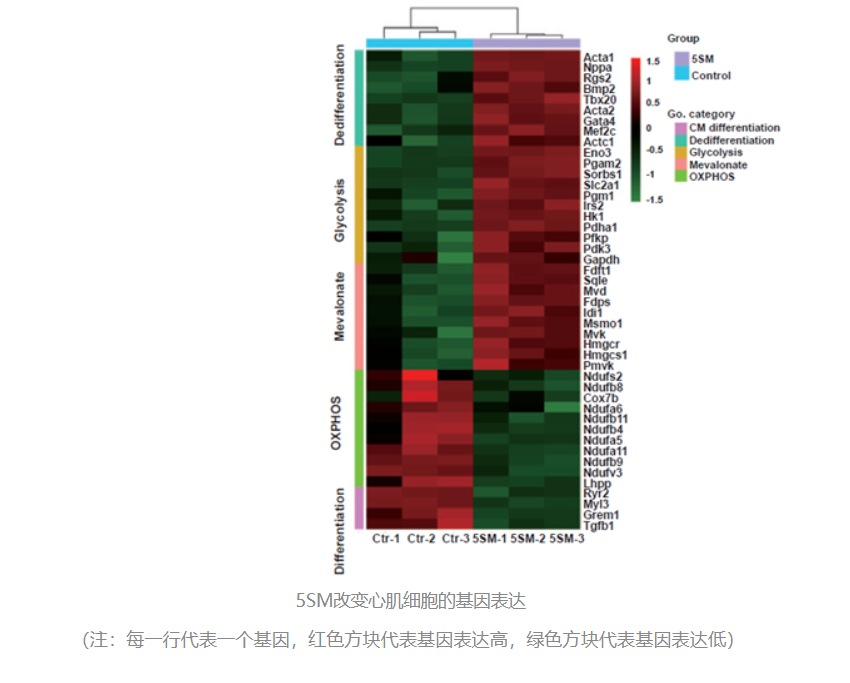
3. 单细胞测序揭示心肌细胞增值通路
既然发现了和增殖及去分化相关的基因,那么新的问题又来了:这些基因是如何让心肌细胞命运的发生改变,实现“返老还童”的呢? 为了回答这个问题,作者将大鼠心室的心肌细胞解离出来,在体外进行了培养,并用5SM进行了处理,然后对处理后的心肌细胞进行了单细胞转录组测序。
通过对单细胞测序结果的分析,作者发现了一条心肌细胞命运转变的通路:
在5SM处理后的心肌细胞中,除了一般心肌细胞会具有的CM1亚型,还有CM2和CM4这两个在没处理的心肌细胞里不会存在的亚型。而且,从发育分化的路径来看,在5SM的刺激下,心肌细胞会沿着C1-C2-C4这条通路再次转变到增殖期。
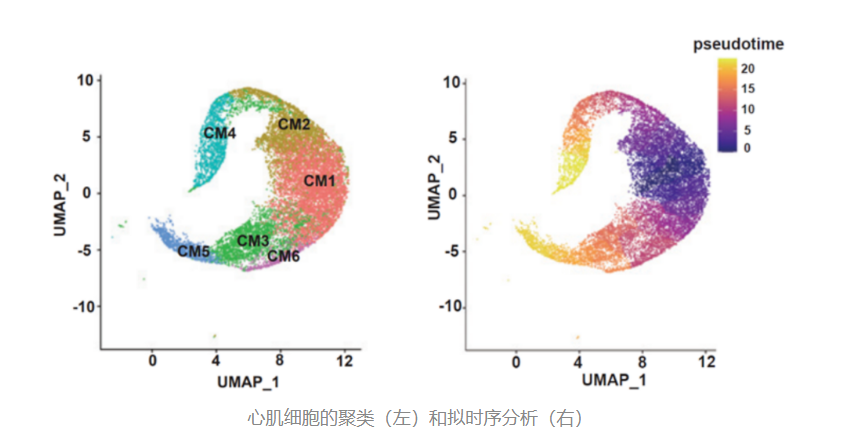
(注:左上图说明通过单细胞测序分析发现了六个心肌细胞(CM)亚群,这些亚群彼此位置的近远,代表不同亚群细胞基因表达相似性高低,越近越相似。图中CM1、CM2、CM4处在相邻的位置,说明它们的基因表达比较相似。右上图说明CM1、CM2、CM4处在一条发育路径上,是发生时间由早到晚的过程。)
这个过程可以认为是心肌细胞的重新激活。成熟的心肌细胞在激活后会重新进入分裂循环,为受损的心脏提供新的细胞来源,从而达到心脏修复的目的。
总结
这篇文章通过对小分子药物的筛选,获得了一组能够促进心肌细胞增殖的药物小分子组合,并通过单细胞测序研究了药物的起效机制,证据链充分,应用价值明显。在单细胞测序技术的助力下,这项研究将处于瓶颈期的心脏再生医学向前推进了一大步,为心梗相关疾病的治疗带来了福音。
参考文献
[1] Fernández-Ruiz I. Rejuvenating cardiomyocytes facilitates heart regeneration. Nat Rev Cardiol. 2021, 18(12):807.
[2] Sadek H, Olson EN. Toward the Goal of Human Heart Regeneration. Cell Stem Cell. 2020, 26 (1):7-16.
[3] Garbern JC, Lee RT. Heart regeneration: 20 years of progress and renewed optimism. Dev Cell. 2022, 57(4):424-439.
